תחום המכשור הרפואי העולמי הוא תחום רווחי בעל פוטנציאל גדול מאוד עבור טכנולוגיות חדשות, וכמובן גם התחרות גדולה בהתאם.
לכן, כשזה מגיע לתחום המכשור הרפואי והבריאות הדיגיטלית – Time is Money!
וזו בדיוק הסיבה שהגשה רגולטורית אפקטיבית היא קריטית בתחום.
לפי הערכות עדכניות, שוק המכשור הרפואי העולמי צפוי לצמוח מסדר גודל של 455 מיליארד דולר בשנת 2021 לכמעט 658 מיליארד דולר בשנת 2028. כלומר, מדובר בתעשייה רווחית עם פוטנציאל גדול מאוד ותחרות גדולה לא פחות. הזמן שלוקח לפתח מכשיר רפואי עד יציאה לשוק, מה שמכונה Time to market, הפך לאחד המניעים התחרותיים המרכזיים ביותר בתחום. הוא משפיע ישירות על ההצלחה ועל הרווחיות של החברה, שכן כל עוד המוצר בפיתוח – אלמנט הרווח אינו רלוונטי.
גורם קריטי בקביעת זמן היציאה לשוק של מכשיר רפואי הוא הזמן שלוקח לקבל אישור מה-FDA/CE או אחרים, כדי למכור את המוצר באופן חוקי. התקנים המחמירים מעמידים את החברות הפועלות בענפים אלו מול חסמי כניסה קפדניים הדורשים תהליכי רגולציה ארוכים ומורכבים וידע וניסיון רב בתחום. הזמן הממוצע הכולל לפיתוח מכשיר רפואי 510(k) מהפיתוח הראשוני ועד לאישור הוא כ-6-8 שנים, והזמן הזה מתורגם לכסף – הרבה כסף!
העלות הכוללת לפיתוח מכשיר רפואי Class II 510(k) מהרעיון ועד אישור ה-FDA הייתה 31 מיליון דולר ב-2010 בממוצע, והעלות הכוללת לפיתוח מכשיר רפואי Class III מהרעיון ועד לאישור קדם-שוק (PMA) הייתה 94 מיליון דולר בממוצע. לפי סקרי שוק עדכניים העלות גדלה בכ-20% בשנים האחרונות ועומדת סביב 37.2 מיליון דולר עבור מכשירי Class II 510(k) ו-112.8 מיליון דולר עבור מכשירי Class III PMA.
כלומר, יש לחברות המפתחות אינטרס מובהק לעשות כל שביכולתם כדי לזרז את התהליך ולהוזיל את העלות הכוללת. ניתן לעשות זאת על ידי ניהול אפקטיבי של התהליכים הרגולטוריים לכל אורך הדרך. הכרות עם הדרישות העדכניות והמשתנות, הבנת תהליכי ההכנה, הערכות והגשה נכונה לאישור הגופים הרגולטורים יכולים לצמצם את ה-Time to market באופן משמעותי. אחת הטעויות הגדולות ביותר שחברות מכשור רפואי עושות, במיוחד סטארט-אפים, היא לא לאמוד נכון את הזמן והעבודה שהגשה ואישור של ה-FDA/CE ידרשו. זה יכול לקחת חודשים רבים לאשר מכשיר או אפליקציה רפואית, בהתאם לסיווג ולגורמים רבים אחרים, ועוד יותר זמן במידה ויש שאלות לגבי ההגשה במידה והתוכן שהוגש אינו שלם.
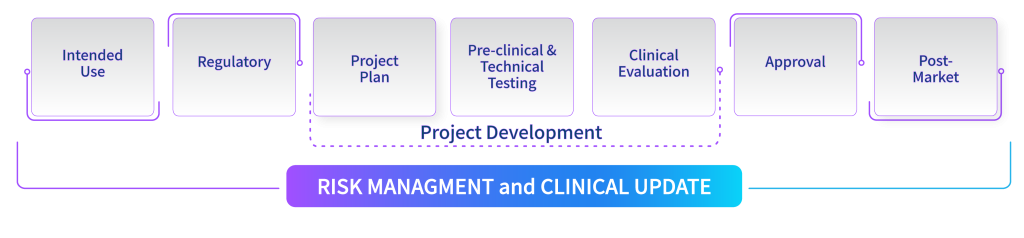
מכיוון שההגשה לאישור הרגולטור הוא השלב האחרון לפני שניתן למכור אותו בשוק, נכון יהיה להבין ולתכנן מראש את הדרישות הרגולטוריות, להחליט על אסטרטגיה רגולטורית, להתאים אותה לתהליך הפיתוח, ולהקצות את הזמן, הכסף והמשאבים המתאימים. הבנה וזיהוי של מסלול האישור של המכשיר מראש, והטמעת תהליכי תיעוד של הפיתוח והעיצוב לפי המסלול המתאים, יחסכו את הצורך בעיבוד חוזר וכמובן ימנעו עיכובים מיותרים.
היועצים של MedDev Soft הם בעלי ובעלות ידע, ניסיון והכרות עם דרישות הרגולציה העדכניות והמשתנות, הנדרשים על מנת ללוות חברות מיכשור רפואי ובריאות דיגיטלית עד להגעה לשלב היציאה לשוק בדרך הישירה והקצרה. המומחים שלנו יסייעו לכם לנהל את התהליכים הנדרשים לצורך האישור הרגולטורי במקביל לעבודת הפיתוח, תוך התאמה מראש למסלול האישור, במטרה לצמצם את הזמן והמשאבים המושקעים עד לפריצה לשוק.
הטמעתה ותחזוקה של מערכת ניהול איכות (QMS), לדוגמה, הינה באחריות יצרני המכשור הרפואי. כמו גם ניהול ה-DHF, ניהול הסיכונים ואבטחת המידע. האלמנטים האלה הם חלק מה-QMS, אבל חשוב להדגיש אותם כחלק מהדרישות המחמירות של הרגולטור. קבצי ה-DHF הם הרשומות המתארות את היסטוריית התכנון של מכשיר מוגמר, כולל סקירת עיצוב, וורפיקציה וולידציה. תהליך ניהול סיכונים גם הוא חלק בלתי נפרד מכל שלב בפרויקט, החל מתכנון ופיתוח ועד בדיקה ואישור, והוא חלק מהותי מדרישות הרגולציה של מערכת האיכות. כך גם לגבי ניהול והוכחת אבטחת המידע.
MedDev Soft מתמחה בכל תהליך הפיתוח – תוכנה, רגולציה, אבטחת סייבר, אבטחת איכות וורפיקציה וולידציה. אנחנו מכירים את ההנחיות והתקנות העדכניות ביותר, שיטות עבודה עדכניות ואת כל הפיתוח העדכניים בתעשייה. בעבודה משותפת המוצר שלכם יגיע בשל לשוק, במהירות ובעלות אפקטיבית.
להתייעצות וליווי מקצועי מוזמנים ליצור קשר עם המומחים של MedDev Soft.







