חברות העוסקות בפיתוח מכשור רפואי ומוצרי רפואה דיגיטליים נדרשות לתהליכי ולידציה כחלק מתהליכי האישור הרגולטורי. חשוב להכיר כי הדרישה לולידציה אינה מתייחסת רק למוצר עצמו ולתוכנות המהוות חלק בלתי נפרד ממנו. התקנים השונים, וביניהם תקן ISO 13485, שמים דגש גם על ולידציה של מערכות הניהול והבקרה בחברה.
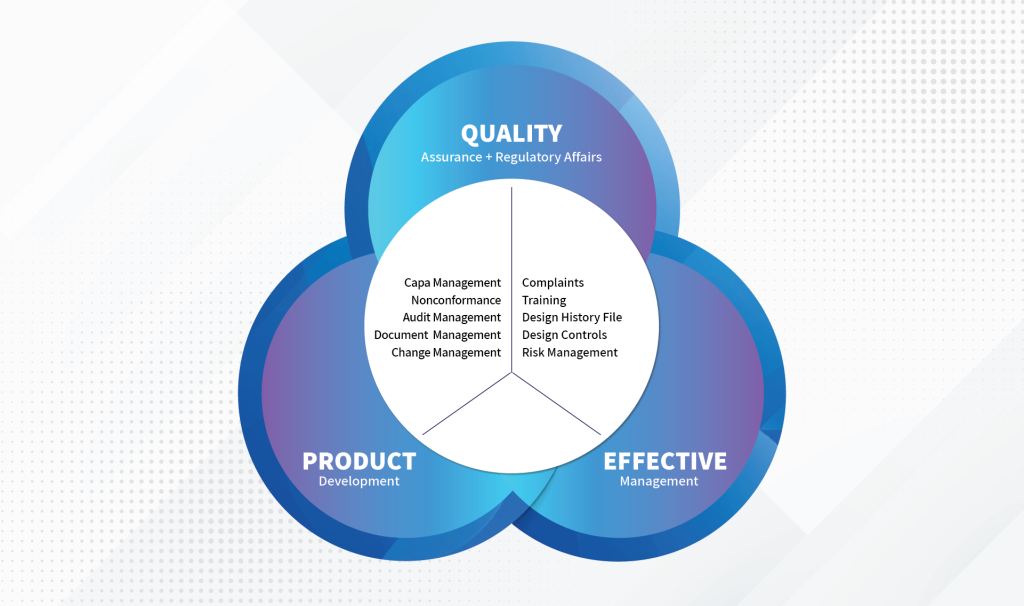
מערכות ממוחשבות, מערכות ניהול ומערכות בקרה נמצאות בשימוש כמעט בכל חברה המפתחת מכשור רפואי. נהוג לכנות מערכות אלו בשם Non Product, משום שאינן מהוות חלק מהמוצר עצמו, אלא משמשות לניהול תהליכי ליבה בחברה. תוכנות לניהול מערכת לאבטחת איכות מסייעות לנהל באופן מסודר ונוח את כל התהליכים בחברה הנוגעים למכשור הרפואי. הן משלבות את כל התחומים הרלוונטיים לעמידה בדרישות וניהול שוטף ומאפשרות מעקב אחר כל הדרוש ביצוע, בניית לוחות זמנים ותוכניות עבודה, ניהול והקצאת משימות לכל בעלי התפקידים, ביצוע תזכורות ועידכון סטטוס שוטף של כל תהליך ומשימה. הודות למערכות אלו, הייצור והפיתוח, האספקה והמשאבים של המכשיר הרפואי, מתוכננים מראש, מנוהלים ומנוטרים בהתאם לכלל הסיכונים ומטרת השימוש של המכשיר הרפואי, כמו גם בהתאם לדרישות הלקוחות המטופלים על ידי המכשיר הרפואי, לרבות שירות ותמיכת לקוחות ופעולות מתקנות בעת הצורך.
בין אם מדובר בתוכנת ERP, תוכנה המחוברת לציוד, אפליקציה, מערכת בקרה או תוכנת ניהול, כולן מחויבות בביצוע ולידציה מלאה בהתאם לדרישות התקן (ISO או CFR21 Part 11). ולידציה היא תהליך בדיקה מבוקר ומתועד, שמטרתו להבטיח כי המוצר יעמוד בדרישות האיכות, היעילות והבטיחות המוגדרות בתקן. הבדיקות מתייחסות הן לשלבי הייצור השונים והן למוצר הסופי, וכאמור עליהן להתייחס גם לכלל התוכנות והמערכות .המשמשות את החברה, אף על פי שהן אינן חלק מהמוצר עצמו.
עמידה בדרישות הרגולציה בעזרת MedDev Soft
פרמטרים קריטיים בניהול מערכת QMS הם הזמן והמאמץ הנדרשים להשגת עקיבות (closed-loop traceability) בין בקרת פיתוח, ניהול סיכונים, מעקב, ולאורך כל מחזור החיים של המוצר והתאמה לדרישות הרגולציה המשתנות והשונות בשוק הבינלאומי המגוון. אנחנו ב MedDev Soft מנוסים בביצוע תהליך וולידציה של מערכות ניהול איכות עבור חברות מכשור רפואי. שירותי הולידציה שלנו מייצרים בסיס איכותי המורכב משילוב תהליכי איכות, בקרות פיתוח תוכנה ופעילויות ניהול סיכונים לאורך כל מחזור חיי המכשיר כדי לשמור על עקיבות ולשפר את התוצאות העסקיות והמטופלים כאחד.
MedDev Soft לא רק מיישרת קו עם דרישות הרגולציה בתעשיית המכשור הרפואי, כמו FDA, ISO ו-EU MDR, אלא מכינה את החברה לעמוד בהן על ידי יצירת תהליכי עבודה מעודכנים ע”פ ההמלצות בתעשייה ושינויים ברגולציה.
ניהול QMS באפס מאמץ – עם הליווי של הצוות המקצועי שלנו, אתם לא צריכים לדאוג שהאימות יהפוך למרכז עלות גדול והצוותים שלכם יכולים להשקיע את זמנם בפעילויות בעלות ערך מוסף מקצועי בפיתוח המוצר.







